CANCER du SEIN : L'Iniparid de Sanofi diminue de 43% le risque de décès
Sanofi-Aventis communique au 5 janvier sur la publication dans The New England Journal of Medicine (NEJM) des résultats définitifs de l’étude de Phase II portant sur son candidat médicament BSI-201 (iniparib). Les résultats de l’étude démontrent un bénéfice clinique significatif chez les femmes atteintes d’un cancer du sein métastatique triple négatif traitées par iniparib en association avec les agents de chimiothérapie gemcitabine et carboplatine et une survie globale augmentée de manière importante.
C'est sa filiale à 100%, BiPar Sciences, qui a mené l'étude « Iniparib plus Chemotherapy in Metastatic Triple-Negative Breast Cancer » (Iniparib en association avec une chimiothérapie dans le cancer du sein métastatique triple négatif) dont les résultats seront également présentés au 35e Congrès de la Société européenne d'oncologie médicale (ESMO) à Milan. Selon les résultats de cette étude multicentrique, randomisée, portant sur 123 femmes atteintes d'un cancer du sein métastatique triple négatif, · Bénéfice clinique : 56 % des patientes du groupe BSI-201 (iniparib) ont montré un bénéfice clinique - défini par une réponse complète ou partielle ou une stabilisation de la maladie d'au moins six mois – vs 34 % (p=0,01) des patientes du groupe chimiothérapie seulement. · La survie sans progression médiane des patientes du groupe BSI-201 (iniparib) s'est pour sa part établie à 5,9 mois, contre 3,6 mois dans le groupe chimiothérapie (IC à 95% (0,39-0,90) HR = 0,59 P=0,01). · Le taux de réponse globale a été de 52 % dans le groupe BSI-201 (iniparib), contre 32 % (p=0,02) dans le groupe chimiothérapie seulement. · La survie globale médiane des femmes traitées par BSI-201 (iniparib) en association avec les agents chimiothérapeutiques gemcitabine et carboplatine s'est établie à 12,3 mois, contre 7,7 mois chez celles traitées par chimiothérapie seulement, ce qui équivaut à une réduction de 43 % du risque de décès.

Les événements indésirables les plus fréquents (de grade 3 et 4) dans le groupe BSI-201 (iniparib) ont inclus la neutropénie, l'anémie, la thrombocytopénie, la leucopénie et la fatigue/asthénie.
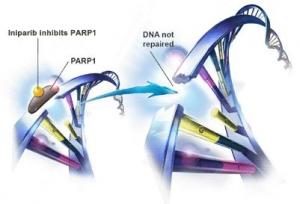
BSI-201 (iniparib) est un nouvel agent antitumoral expérimental qui présente une activité inhibitrice de la poly-(ADP-ribose) polymérase (PARP) et pour lequel la FDA a accepté une procédure d'examen accélérée. Il représente une nouvelle option de traitement pour les cancers du sein triple négatifs soit 15 à 20% de tous les cancers du sein, qui ne sont pas réceptifs aux traitements hormonaux ou ciblé par Herceptin (HER2). Les dossiers réglementaires devraient être soumis au premier trimestre 2011 aux États-Unis et au deuxième trimestre 2011 dans l'Union Européenne.
Devenez membre PREMIUM
Accèdez sans limite aux 15 000 actualités du site
et recevez gratuitement chaque semaine,
la Newsletter Santé log avec les actus Santé à ne pas manquer !

Je suis déjà membre PREMIUM
