COVID-19 : Une protéine de pointe plus robuste explique la virulence des variants
Une protéine de pointe « plus robuste » explique, selon cette équipe du Boston Children's Hospital, la propagation plus rapide des nouvelles variantes du coronavirus. Cette étude, menée par cryo-microscopie électronique (Cryo-EM) révèle, dans la revue Science, comment les altérations structurelles des variantes G614 stabilisent la protéine de pointe et renforcent sa capacité à se lier aux récepteurs ACE2 de nos cellules, ce qui rend le virus encore plus infectieux.
Les « nouvelles » variantes ayant émergé au Royaume-Uni, en Afrique du Sud et au Brésil se propagent plus rapidement et soulèvent des questions sur l’efficacité des vaccins actuellement disponibles. L’équipe de Boston a donc cherché à comprendre cette virulence en analysant comment la structure des protéines de pointe de coronavirus a changé, avec la mutation G614, une mutation partagée par ces 3 variantes. Leurs travaux montrent pourquoi ces variantes sont capables de se propager plus rapidement.
La protéine de pointe décryptée à la résolution atomique.
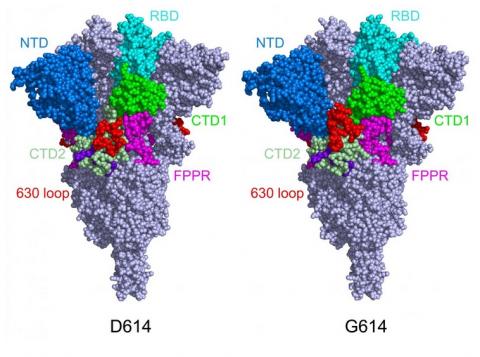
A l’aide de la Cryo-EM, une technique d’imagerie de pointe, les chercheurs constatent que la mutation D614G (substitution d'une seule «lettre» d'acide aminé dans le code génétique de la protéine de pointe) rend le pic plus stable par rapport au virus originel. En conséquence, les « pics » deviennent plus fonctionnels, se lient plus facilement aux récepteurs ACE2 des cellules hôtes, ce qui renforce l’infectiosité du virus (Voir visuel : structure de la protéine de pointe dans sa configuration fermée, dans sa forme d'origine (à gauche) et sa forme mutante (à droite)).
Dans le coronavirus d'origine, les protéines de pointe se lieraient au récepteur ACE2, puis changeraient radicalement de forme, se repliant sur elles-mêmes. Cela permet au virus de fusionner sa membrane avec les membranes de nos propres cellules et de pénétrer à l'intérieur. Cependant, dans certains cas, les pointes changeaient parfois prématurément de forme et s'effondraient avant que le virus ne puisse se lier et infecter les cellules. Si ce changement de forme pouvait « ralentir » le virus, il rendait également la tâche plus difficile pour notre système immunitaire.
Dans les formes variantes, la mutation D614G stabilise la pointe en bloquant ce changement de forme prématuré. Curieusement cette stabilité induit que les pointes se lient moins fortement au récepteur ACE, mais le fait que les pointes ne se désagrègent plus du tout, rend globalement le virus beaucoup plus infectieux.
En résumé, le virus d'origine a 100 protéines de pointe mais en raison de leur instabilité seules 50% sont fonctionnelles. Dans les variantes avec mutation G614, 90% sont fonctionnelles, donc même avec une liaison plus faible, le risque d’infection reste plus élevé.
Les auteurs suggèrent à redévelopper les vaccins de manière à intégrer le code de cette protéine de pointe mutante mais songent également à mettre au service de nouveaux traitement cette nouvelle compréhension de la liaison du virus aux cellules hôtes : déjà à l’étude, une protéine ACE2 « leurre » structurellement conçue pour se lier au virus et à ses variants 200 fois plus fortement que l'ACE2 du corps et qui pourrait constituer un traitement anti-COVID prometteur…
Devenez membre PREMIUM
Accèdez sans limite aux 15 000 actualités du site
et recevez gratuitement chaque semaine,
la Newsletter Santé log avec les actus Santé à ne pas manquer !

Je suis déjà membre PREMIUM
