PANDEMRIX®: L'Agence européenne inscrit le risque de narcolepsie
Parmi les points discutés en commission d’AMM de l’Afssaps, du 28 avril, les cas de narcolepsie survenus chez des enfants et des adolescents après vaccination avec le vaccin pandémique Pandemrix (GlaxoSmithKline) rapportés en Norvège, en Suède et en France. Le Comité des médicaments à usage humain (CHMP) de l’Agence européenne a débuté une évaluation, à la demande de la Commission européenne en août 2010. Les résultats de cette évaluation devraient être connus en juillet prochain. Dans cette attente, le risque de narcolepsie sera intégré au RCP ou résumé des caractéristiques de ce vaccin. L’Agence européenne reconnaît, ainsi officiellement, ce risque.
C'est ce que révèle l'Afssaps, dans son communiqué de compte rendu de Commission AMM du 28 avril. L'Afssaps précise que le vaccin Pandemrix® n'est plus distribué en France. Néanmoins, les professionnels de santé vont être avertis, afin de prendre en compte ce risque lors de la prescription de Pandemrix aux enfants et adolescents.
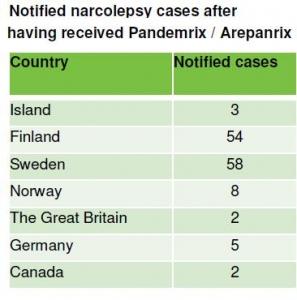
En France, au total, 25 cas de narcolepsie -un trouble du sommeil se caractérisant par une somnolence excessive au cours de la journée- avaient été rapportés, dont 23 après vaccination par Pandemrix® portent sur 5,7 millions de personnes vaccinées avec Pandemrix® et Panenza®, dont 11 chez des enfants âgés de moins de 16 ans, avec, précisait alors l'Afssaps, dans son actualisation d'avril 2011, un nombre de cas rapportés chez les adolescents vaccinés supérieur au nombre de cas attendus dans cette tranche d'âge. Pour l'Agence française, il s'agissait alors “d'un signal faible que le suivi particulier de pharmacovigilance mis en place au cours de la vaccination contre le virus de la grippe A/H1N1 avait permis de faire remonter”.
Dès août 2010, les autorités sanitaires finlandaises et suédoises avaient, les premières, signalé plusieurs cas de narcolepsie chez des personnes ayant été vaccinées contre la grippe A/H1N1 durant la campagne de vaccination pandémique 2009-2010. Le CHMP avait conclu, en février dernier, à une insuffisance de données. L'OMS avait alors appelé à une enquête approfondie. En Europe près de 200 cas de narcolepsie ont été rapportés dans une période de 1 à 6 mois après la vaccination, principalement par les autorités finlandaises et suédoises sur environ 30 millions de sujets vaccinés.
Rappelons qu'une nouvelle législation européenne relative à la pharmacovigilance a été publiée fin 2010 pour permettre une meilleure harmonisation des informations de sécurité d'emploi délivrées aux patients européens. En particulier la définition de l'effet indésirable est élargie aux réactions nocives survenues dans toutes les situations d'utilisation (mésusage, abus, surdosage, erreurs médicamenteuses et leur signalisation sera centralisée dans une seule base de données européenne, Eudravigilance.
Source: Communiqué Commission d'AMM du 28 avril, Autres sources : Actualisation données Pandemrix® Afssaps du 4 avril 2011 European Medicine Agency (EMA) « Meeting highlights from the Committee for Medicinal Products for Human Use (CHMP) 14-17 February 2011 » « EMA reviews further data on narcolepsy and possible association with Pandemrix », European Medicines Agency reviews further data on narcolepsy and possible association with Pandemrix, Finnish National Institute for Health and Welfare : The interim study report
Devenez membre PREMIUM
Accèdez sans limite aux 15 000 actualités du site
et recevez gratuitement chaque semaine,
la Newsletter Santé log avec les actus Santé à ne pas manquer !

Je suis déjà membre PREMIUM
