PHARMACOVIGILANCE: Effets indésirables ou mésusage, le nouveau devoir de déclaration
C’est une grande première en France, qui marque une volonté de transparence de la part des Autorités sanitaires sur le circuit du médicament. Cette possibilité offerte aux patients ou aux associations de signaler les effets indésirables mise en place par l’Afssaps va permettre d’optimiser la surveillance du risque lié au médicament, tout en responsabilisant les usagers de Santé et en fournissant à terme, aux professionnels comme au grand public des données plus complètes et plus transparence de pharmacovigilance. Un système plus ouvert de surveillance du médicament qui pourrait permettre d’identifier plus rapidement, grâce à un nombre de déclarations plus important les risques associés au médicament lui-même mais également à ses mésusages. On peut penser, par exemple, que l’AMM du Mediator n’aurait probablement pas été maintenue aussi longtemps avec un tel système.
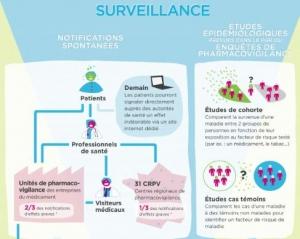
L'objectif est d'élargir la base de recueil et de détecter des signaux complémentaires de ceux rapportés par les professionnels de santé, avec la volonté de faire participer tous les acteurs du dispositif et de lui donner une transparence accrue.
Si les Professionnels de santé étaient appelés à déclarer par le site de l'Afssaps les effets indésirables constatés sur leurs patients, et tout particulièrement sollicités pour les médicaments à modification d'indications, sous réévaluation ou sous surveillance de l'Agence, aujourd'hui les patients ou leur représentant, les parents pour leurs enfants par exemple ou encore les associations de patients pourront déclarer l'ensemble des événements indésirables liés à la prise d'un médicament, à l'aide du du formulaire de déclaration spécifique mise en ligne sur le site de l'Afssaps.
Les effets indésirables que le patient ou son entourage suspecte d'être liés à l'utilisation d'un ou plusieurs médicaments, y compris lors de la grossesse ou de l'allaitement, ou encore les mésusages, abus ou erreurs médicamenteuses. La déclaration doit être effectuée le plus tôt possible, après la survenue du ou des effets indésirables et à l'attention du centre régional de pharmacovigilance (CRPV) dont le patient dépend géographiquement.
Une nouvelle mesure qui s'inscrit dans le cadre de la loi HPST et de la nouvelle réglementation européenne et qui fait suite à la réalisation d'une étude-pilote, menée en 2006-2007 afin d'évaluer les outils nécessaires à la mise en place d'un tel système et d'en mieux cerner les apports qualitatifs. Dans le cadre de cette étude, ainsi plus de 1.000 déclarations auraient pu être remontées par les associations de patients impliquées.
L'Afssaps met aussi en ligne, un guide d'utilisation du formulaire, pour une meilleure évaluation, ensuite, par le centre régional de pharmacovigilance, du lien entre le médicament et l'effet indésirable constaté, à partir des données transmises par le patient.
Devenez membre PREMIUM
Accèdez sans limite aux 15 000 actualités du site
et recevez gratuitement chaque semaine,
la Newsletter Santé log avec les actus Santé à ne pas manquer !

Je suis déjà membre PREMIUM
